前言:
近日,在国家药品监督管理局推动下,浙江省医疗器械唯一标识实施工作推进会议明确指出,今年10月1日开始,所有新上市的医疗器械必须绑定UDI唯一标识码,这意味着浙江省将进入医疗器械产品流通数据监管的时代。

浙江省并不是该政策的唯一试点省份,国家药监局联合国家卫健委在7月份已经召开了全国医疗器械唯一标识试点推进会议,未来将在全国各省落地实施。
该政策的落地实施,国家药品监督管理局出台了一系列相关政策法规,配合医疗器械UDI唯一标识码建立标准及系统规则,围绕着唯一识别信息建立标识数据库,并呼吁各医疗机构在政策落地后应配合开展唯一标识的临床应用。
UDI唯一标识将包含医疗器械的企业信息、产品基本信息以及生产动态信息,更关键的是UDI码将关联医疗机构电子病历,实现研发生产、临床使用、术后追溯的全流程监管。
一械一码”,从生产到流通,医械企业将迎最严监管。
那么唯一器械标识(UDI)到底是什么?
01、什么是UDI?
医疗器械唯一标识(Unique Device Identification,UDI)是美国FDA建立的”特殊医疗器械的识别系统”,是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。
医疗器械唯一标识UDI= 产品标识(DI)+生产标识(PI)
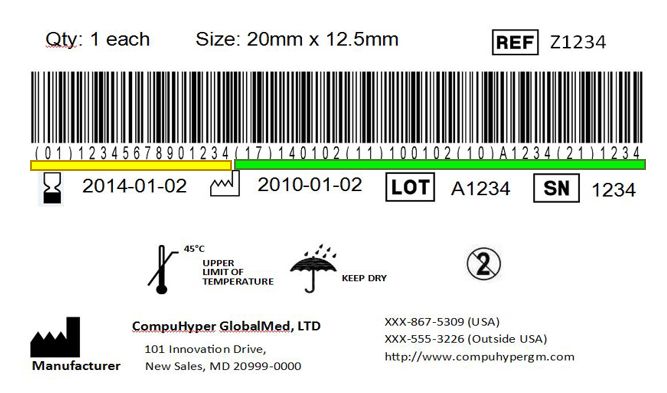
产品标识(DI)
产品标识是UDI强制的固定部分,用来识别医疗器械贴标主体、特定版本或型号的医疗器械,一旦确定,无法改变;且DI可以进入全球UDI数据库(GUDID)。
生产标识(PI)
生产标识是UDI的可变部分,可包括批次、序列号、生产日期、失效日期等信息,I类产品不需要。
医疗器械包装
• 医疗器械包装包含固定数量的特定版本或型号的器械
• 每一层级的包装需要不同的UDI
注:货运包装(例如集装箱、托盘)不是医疗器械包装,不需要UDI。

除了标签之外,如果是以下医疗器械,医疗器械本身也必须带有永久标记UDI:
*医疗器械需不止一次使用
*每次使用前都要进行再处理的医疗器械
UDI可通过以下任一或两者提供:
*易于阅读的纯文本*自动识别和数据捕获(AIDC)技术或任何可根据需要提供UDI的替代
技术永久标示于医疗器械本体的UDI可以是:
*与出现在医疗器械标签上的UDI相同
*不同的UDI用于区分未包装的医疗器械与已包装的医疗器械。
02、UDI的推行有什么好处?
国际化进程的加速发展,必然将对整个供应链中医疗器械数据信息的共享、传递提出更高的要求。面对目前我国医疗数据信息化的分散、滞后等问题,一个全球统一的国际标准无疑是维护政府、患者、企业相关权益的必要前提,同时,促进中国医疗器械行业向国际化标准发展。
从政府层面来讲,建立UDI系统,可以从源头统一医疗器械身份标识,有利于加强医疗器械在研制、生产、经营及使用各环节的监督管理,提升医疗器械监管整体效能,创新医疗器械监管模式。
国家药监局器械注册司相关人员表示,“为每一个医疗器械赋予身份证,追溯到最小销售单元,可实现产品全生命周期可追溯。医疗器械生产、销售、使用、上市后再评价等各环节都可以使用UDI开展工作。”
研讨会上,代表们还表示,UDI试点工作离不开各相关部门的共同推动。各相关部门实现数据共享后,UDI试点将不仅仅有助于医疗器械监管和产品追溯,还可以助推三医联动。
其次,利用医疗器械唯一标识,就可以串联起不同环节的应用,可以有效掌握医院的产品使用情况。
从企业层面来讲,UDI可以帮助实现产品全程追溯。同时,UDI有助于企业打通内部供应链,连接企业内部研发、生产等信息系统数据,并助力企业不良事件报告和开展再评价,以及不良产品的及时召回。各大医疗器械体系在推广UDI的介绍词中都包括了安全性,可追踪性,高效性。
从患者层面来讲,UDI系统能够提高用户的安全、新型医疗器械售后监管和帮助医疗器械的革新。

考虑到使用者的安全,当UDI系统完备后,有质量风险的医疗器械将会更容易被追踪和监控,对于不良事件的反馈可以更加有效,审查和分析更加准确,有助于使用者最快时间内解决安全隐患,同时也便于医疗保险的清算。
一旦假冒伪劣产品流入市场,查询GUDID数据库关于销售网络的情况,便于使用者判断产品真伪。
事实上,业界针对植入类等高风险产品推行UDI已经有不少呼声。患者在接受植入手术后,其所植入器械的厂商信息、规格型号等植入产品信息往往是患者最关心的。在紧急情况下,相关人员可通过植入产品信息快速准确了解患者情况。
03、物联技术RFID与UDI
物联网技术在医疗领域的应用潜力巨大,能够帮助医院实现对人的智能化医疗和对物的智能化管理工作,支持医院内部医疗信息、设备信息、药品信息、人员信息、管理信息的数字化采集、处理、存储、传输、共享等。
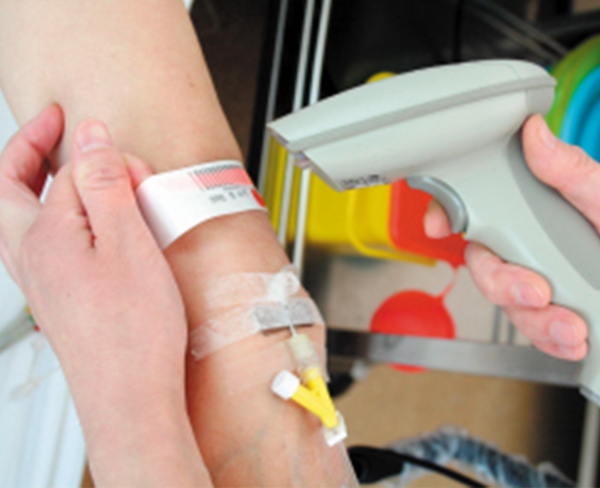
(RFID医疗腕带的应用)
RFID作为物联网的核心技术,已广泛应用于医疗领域。随着UDI不断地被人们所提及,对于它的疑问也越来越多,其中不乏有关RFID在UDI项目中的适用性问题,下面就是小编收集了有关RFID与UDI的问题几个常规问答。
Q: 如果对医疗设备唯一标识采用RFID技术,还需要在资产上标记条码吗?
A: 不需要。条码或二维码不满足UDI要求。FDA明确指出UDI标识不是用条码或二维码,因为UDI的目的是为用户提供自动识别技术,只有这样的技术才能够更好的满足资产管理的需要。
Q: 在UDI条款生效之前,是否需要对医疗资产采用具备追溯功能的标签?
A: 不一定,但这是需要考虑的事情。UDI提出了对设备追溯和管理信息的一致性要求。这些规范性的要求对资产管理、库存控制和业务流程管理非常重要。否则,不同企业或组织就会产生不统一的数据管理形式,可能会导致业务流程和操作环节的失误。组织内纳入自动管理系统的资产越多,整个管理系统就会更有价值。
Q: RFID可以满足“直接标记”资产的要求吗?
A: 是的。FDA要求每个非一次性使用的医疗资产上拥有永久性的唯一标识,这就会牵涉到“直接标记”的概念,UDI的目标对象是设备,而不仅仅是包装。“标记”本来的意思是在设备上标记一个条码或者二维码,但这并不满足UDI的要求。只有在设备上永久标识或者嵌入标识才能满足UDI要求。RFID可为UDI提供数据载体
RFID(射频标签)具有信息存储功能,能接收读写器的电磁调制信号,并返回相应信号。
射频标签的载体成本和识读设备成本相较于一维码和二维码要高,但读取速度快,可以实现批量读取。注册人/备案人可根据产品的特征、价值、主要应用场景等因素选择适当的UDI数据载体。
04、UDI是医疗器械的国际语言
在医疗器械中推行UDI已经是国际趋势。美国、欧盟、日本等国家和地区均在积极推进UDI相关工作。”中国食品药品检定研究院副院长张志军说。
国际医疗器械监管机构论坛((IMDRF)从2011年提出《医疗器械UDI系统》指导文件,UDI不再是美国独有的医疗器械唯一识别码,而成为世界范围的医疗器械规范的识别码(globally harmonized UDI system)。
2013年,美国发布医疗器械唯一标识系统法规,决定按照风险等级,在医疗器械中逐步实施UDI。
美国FDA已经针对法规发布多个指南文件,目前第三类、第二类医疗器械已经实施UDI。同年,欧盟发布了医疗器械唯一标识系统通用框架的建议,并在2018年5月发布的医疗器械法规和体外诊断试剂法规中增加了UDI专章,将于2021年5月起,按照医疗器械产品类别和风险逐步实施。
日本则早在2008年就发布了UDI条形码显示通知,目的是提高物流和医保结算的效率,并建立了医疗器械数据库系统。

医疗器械国际监管机构论坛(IMDRF)成立了专门的UDI工作组,目前已经制定了2份技术性文件,构建了全球协调UDI系统的框架内容。国家药品监督管理局副局长徐景和直言:UDI是医疗器械的国际语言。医疗器械唯一标识是信息时代数字化管理发展的必然趋势,是全球医疗器械监管手段创新和效能提升的发展方向。
UDI是行业近年来最重磅的政策之一,通过提升产品的可追溯性,实现对医疗器械安全监管,助力医疗器械产业高质量发展。企业UDI编码制度的建立要考虑到实际情况,合适的UDI制度能降低企业内部管理成本,但如果盲目选择发码机构,没有贴合产品和企业的实际需求,那么UDI也可能会变成一种负担。
资料来源:众成医械研究院、搜狐新闻、OFweek、迈卓德大器械、网络信息
未注明图片源于:网络
如有侵权,请与我们联系。我们将立即删除
了解更多资讯,敬请关注 “传麒视界”
